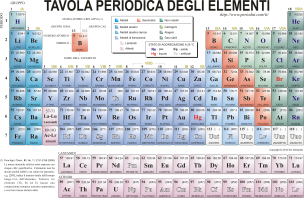
La tavola periodica è uno strumento utilizzato dai chimici per lo studio degli elementi e dell’atomo. l’idea di una tavola Ordinata nasce dopo il 1830, quando si conoscevano ben 55 elementi dalle proprietà fisiche e chimiche diverse.
Anche se nel 1780 Döbereiner, che divise gli elementi in gruppi di 3 a seconda delle caratteristiche fisiche e chimiche(la sua tavola, però, non era approvata perché non si poteva inserire tutti gli elementi nelle Triadi); furono in seguito provati altri metodi di classificazioni secondo la massa atomica, ma la prima tavola periodica fu ideata da Mendeleev enl 1869, il quale utilizzava come criterio di classificazione il numero di massa A (che equivale alla somma dei Protoni + e neutroni 0) per ordinare i 63 elementi conosciuti fino ad allora.
 come possiamo vedere dall’immagine la tavola è composta da 8 file verticali (chiamati gruppi) e 12 orrizzontali (chiamati Periodi); Il primo degli elementi è l’idrogeno (H) e l’ultimo è l’uranio (U). la classificazione è il ordine crescente di A. Seguendo i Periodi possiamo notare che le caratteristiche chimiche e fisiche variano gradualmente. Seguendo i gruppi possiamo notare che le caratteristiche chimiche sono simili (esempio il secondo gruppo contiene tutti elementi ferrosi che reagiscono violentemente con l’acqua). Nella tavola periodica vi sono vari spazi vuoti, essi sono dedicati agli elementi ancora sconosciuti.
come possiamo vedere dall’immagine la tavola è composta da 8 file verticali (chiamati gruppi) e 12 orrizzontali (chiamati Periodi); Il primo degli elementi è l’idrogeno (H) e l’ultimo è l’uranio (U). la classificazione è il ordine crescente di A. Seguendo i Periodi possiamo notare che le caratteristiche chimiche e fisiche variano gradualmente. Seguendo i gruppi possiamo notare che le caratteristiche chimiche sono simili (esempio il secondo gruppo contiene tutti elementi ferrosi che reagiscono violentemente con l’acqua). Nella tavola periodica vi sono vari spazi vuoti, essi sono dedicati agli elementi ancora sconosciuti.
Perché gli elementi presentano ciclicamente proprietà chimiche e fisiche SIMILI?
La ciclicità dipende dalla configurazione elettronica degli atomi. Infatti nei diversi atomi dello stesso gruppo la configurazione periodica degli elettroni (il numero di Elettroni nell’ultimo livello energetico) è sempre uguale.
LA MODERNA TAVOLA PRIODICA
Molti degli elementi non erano ancora scoperti alla nascita della tavola di Mendeleev, ma per il resto la forma della tavola periodica è ancora utilizzata. La principale differenza tra la tavola moderna e quella di Mendeleev è il criterio di classificazione degli elementi; Infatti mentre mendeleev seguiva il numero di massa A, nella moderna tavola periodica si utilizza il numero atomico Z (il numero di protoni, e di elettroni SE l’atomo è neutro, presenti nell’atomo).
Anche la tavola periodica Moderna è formata da Gruppi e Periodi:
- GRUPPI: Le colonne verticali della tavola, essi equivalgono al numero di ELETTRONI nell’ultimo livello energetico dell’atomo. Questi elettroni prendono il nome di ELETTRONI DI VALENZA. ►questo vale solo per i gruppi segnati dai NUMERI ROMANI◄
- PERIODI: Le righe orizzontali della tavola, essi equivalgono all’ULTIMO LIVELLO ENERGETICO dell’atomo. Questo Livello energetico prende il nome di GUSCIO DI VALENZA. In totale i periodi sono infiniti, ma sono solo 7 quelli impiegati per gli elementi terrestri. { questo valore equivale al numero quantico “n” }
Gli elementi presenti nella tavola periodica, in totale, sono 118 (anche se il Tecnezio, il promezio, l’astato e gli elementi successivi al Uranio, sono elementi artificiali)
L’ultima colonna (il gruppo VIII) è la colonna dei GAS NOBILI, cioè 6 elementi (He, Elio; Ne, Neon; Ar, Argon; Kr, Cripton; Xe, Xenon; Rn, Radon) sono reattivamente nulli, questo perché i livelli energetici sono “Completi”, cioè il numero di Elettroni è sufficiente a completare l’ottetto del livello energetico.