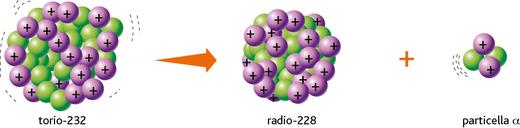
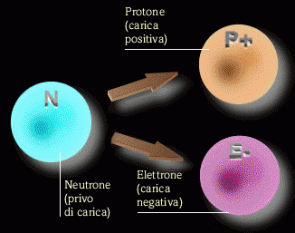
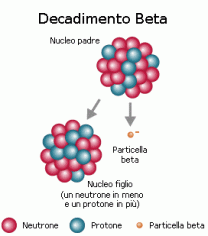
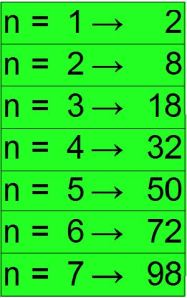OGNI atomo di un elemento è composto da 3 particella subatomiche:
ELETTRONE-
PROTONE+
NEUTRONE0
Queste particelle sono diverse tra loro sotto ogni punto di vista:
ELETTRONE
Scoperto nel 1897 da J.J.Thomson, venne notato che se la materia viene sfregata vi è un passaggio di carica elettrica, quindi sfregando due oggetti avviene un passaggio di elettroni, questo perché gli elettroni compongono lo strato esterno dell’atomo. L’elettrone ha una carica negativa pari ad -1u. La massa dell’elettrone è 20 volte inferiore alla masse del protone e del neutrone, infatti ha il valore di 9.109 · 10^-31. Nella tavola periodica ha lo stesso valore di Z (questo perché gli elementi nella tavola periodica sono rappresentati TUTTI con carica NEUTRA)
IL VALORE PUO’ VARIARE ► IONE
PROTONE
Scoperto nel 1885 da Eugene Goldstein, venne notato che la materia ha carica elettrica neutra, quindi nell’atomo esistono particelle di carica positiva le quali eliminano la carica dell’elettrone. Il protone ha una carica positiva pari ad 1u. La massa protone è 20 volte superiore alla masse dell’elettrone e simile a quella del neutrone, infatti ha il valore di 1.673^-27. Nella tavola periodica ha lo stesso valore di Z
IL VALORE NON PUO’ VARIARE (eccezione per gli elementi radioattivi)
NEUTRONE
Scoperto nel 1932 da James Chadwick, venne notato che la massa dell’atomo era superiore alla somma della massa del protone e dell’elettrone, quindi nell’atomo esistono particelle di carica neutra le quali non variano la carica dell’atomo, ma variano la massa. Il neutrone ha una carica neutra pari ad 0u. La massa neutrone è 20 volte superiore alla masse dell’elettrone e simile a quella del protone, infatti ha il valore di 1.675^-27. Nella tavola periodica ha lo stesso valore di A-Z
IL VALORE PUO’ VARIARE ► ISOTOPO
IL VALORE DI A → detto “numero di massa” è la somma dei PROTONI+ e dei NEUTRONI0
IL VALORE DI Z → detto “numero atomico” è il numero di PROTONI + (e in caso l’atomo non sia uno IONE è anche il numero di ELETTRONE-)
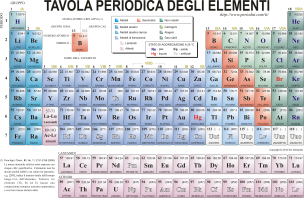
Nella Legenda della tavola periodica specifica come siano scritti A e Z, ma nella scrittura chimica Z viene scritto in basso a sinistra, mentre A viene scritto in alto al sinistra.
Come si calcola la massa atomica?
La massa atomica equivale alla somma dei prodotti degli isotopi di un elemento per la percentuale di concentrazione, il tutto fratto 100
ESEMPIO
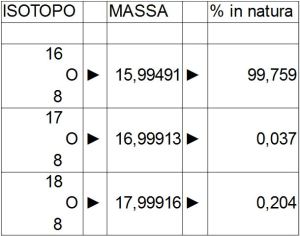
tabella rappresentante i 3 isotopi dell’ossigeno
La massa dell’ossigeno è:
(15.99491*99.759+16.99913*0.037+17.99916*0.204)/100 = 15.99937
![]()




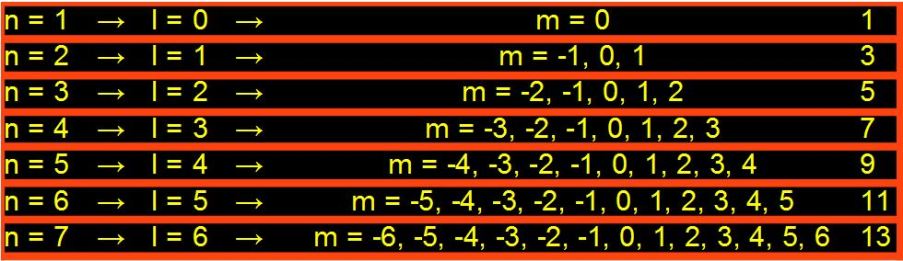
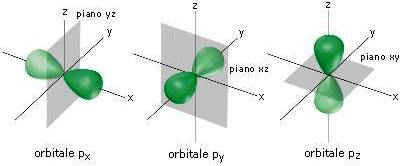
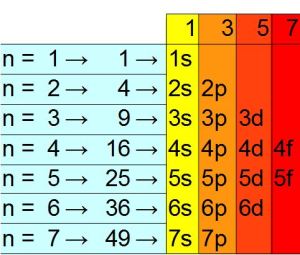
 In questa immagine si vedono i 7 livelli energetici di un atomo. Questi sono tutti completi di elettroni secondo un ordine preciso e un
In questa immagine si vedono i 7 livelli energetici di un atomo. Questi sono tutti completi di elettroni secondo un ordine preciso e un 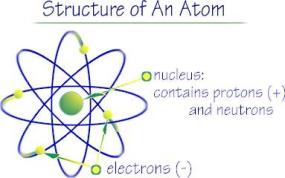
 , ma vengono considerati solo i livelli energetici da 1 a 7 perché basta a classificare tutte e 118 gli elementi terrestri.
, ma vengono considerati solo i livelli energetici da 1 a 7 perché basta a classificare tutte e 118 gli elementi terrestri.